
Teoría y aplicaciones del ORP
De manera similar a la forma en que las soluciones ácidas o alcalinas se cuantifican mediante mediciones de pH, las soluciones también se pueden clasificar como oxidantes o reductoras en función de las mediciones de ORP (potencial de óxido reducción o también llamado potencial “redox”).
Cuando un agente oxidante y/o reductor se disuelve en una muestra acuosa, puede reaccionar con los materiales presentes y producir un voltaje o fuerza electromotriz (EMF), que corresponde a la relación de oxidantes que reducen las especies en la muestra. Se puede desarrollar un intercambio de electrones entre esta solución y un sensor con metal inerte sumergido en la solución, y el voltaje se puede medir (cuando se compara con un electrodo de referencia) con un medidor de pH/mV. Este tipo de mediciones se conocen como redox u ORP. Las unidades de medición están en mV.
La escala de medición puede ser positiva (que indica un potencial oxidante) o negativa (que indica reducción). Cabe señalar que cuando se observa cero mV, es realmente una situación oxidante debido a que el voltaje de referencia (̴ 200 mV para un electrolito de Ag/AgCl con KCl) se incluye en el valor de mV observado. En algunos casos, es posible que el usuario desee compensar la lectura para eliminar la contribución de la referencia. Se dice entonces que los mV se acercan a la escala de mV absoluto que hace referencia a un electrodo de hidrógeno estándar. Este tipo de calibración se conoce como calibración de mV relativa.
A simple vista, un electrodo ORP se parece a un electrodo de pH. Al igual que un electrodo de pH combinado, tanto el sensor como la referencia se encuentran alojados en un solo cuerpo. Un sensor de ORP debe ser químicamente inerte; no se puede oxidar ni reducir. También debe tener las características de superficie adecuadas para promover el intercambio rápido de electrones, una propiedad conocida como alta densidad de corriente de intercambio. Dos metales nobles han demostrado funcionar bien para este propósito: el platino y el oro puros, ambos se utilizan en la construcción de sensores de ORP
El sensor de platino se prefiere debido a que es mecánicamente más simple y seguro de producir. El platino se puede soldar al vidrio y tienen el mismo coeficiente térmico. Los sensores hechos de oro no pueden soldarse al vidrio y por lo general se colocan en un soporte de plástico aplicados al vidrio o tubo de plástico por medio de un pequeño tapón de elastómero. La señal del sensor de oro o platino se transporta a través del cuerpo del electrodo, y junto con la señal de referencia se conducen al medidor por medio de un cable coaxial con conector BNC.
Un sistema de ORP no tiene una fuente de alta impedancia (como el bulbo de pH), sino que es un dispositivo potenciométrico que produce un voltaje. También utiliza cables, conectores y soluciones de calibración similares. Por esta razón, un medidor electrónico de alta impedancia (pH) es útil para esta medición.
Debido a la estrecha relación entre un electrodo de pH y ORP, existe una escala que toma en cuenta la relación (mV) ORP/pH, la escala rH. El intervalo de rH varia de 0 a 42, donde los valores extremos representan el efecto reductor de una atmósfera de hidrógeno puro (rH=0) y el efecto oxidante de una atmósfera de oxígeno puro (rH=42), respectivamente.
La fórmula para obtener el valor rH es:
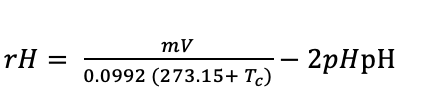
Donde T es la temperatura (°C) de la muestra, mV es la lectura ORP (mV) y pH es el valor de pH de la muestra.
Aplicaciones
Las mediciones de ORP se basan en la diferencia de potencial medido entre el electrodo de platino u oro y el electrodo de referencia. El mismo sistema de referencia utilizando para el electrodo de pH (Ag/AgCl) también se usa para las mediciones redox.
Los electrodos redox se usan para controlar muchos procesos químicos, en particular los que involucran reacciones reversibles. Por ejemplo, los sistemas redox usados en tratamiento de agua son la reducción de cromatos y la oxidación de cianuros. El cromo hexavalente es reducido a cromo trivalente adicionando bisulfito de sodio o dióxido de azufre. En el caso del cianuro, se utiliza hipoclorito de sodio o cloro para oxidarlo, seguido por la hidrólisis del cianato a amoníaco y dióxido de carbono.
Hanna cuenta con el electrodo de ORP HI3620D, el cual es un electrodo combinado con punta de platino y cuerpo de polieterimida ideal para aplicaciones de campo. Este electrodo tiene una sola unión de cerámica y referencia de Ag/AgCl.
A continuación, se muestra una tabla con las especificaciones del electrodo de ORP HI3620D

| Código | HI3620D |
| Descripción | Sonda de ORP |
| Referencia | Simple, Ag/AgCl |
| Electrolito | Gel |
| Presión máxima | 2 bar |
| Intervalo | ORP: ±2000 mV |
| Temperatura de operación recomendada | -5 a 70°C (23 a 158°F) |
| Forma/punta | Pin/platino |
| Sensor de temperatura | Sí |
| Amplificador | Sí |
| Material del cuerpo | PEI |
| Cable | Coaxial; 1 m (3.3’) |
| Uso recomendado | Aplicaciones de campo |
| Conexión | DIN |
